PROCESOS TERMODINAMICOS
1. Definición:
Se define como el campo de la física que describe y relaciona las propiedades físicas de sistemas macroscópicos de materia y energía. Los principios de la termodinámica tienen una importancia fundamental para todas las ramas de la ciencia y la ingeniería.
2. Tipos de procesos termodinámicos:
Proceso Isotérmico:
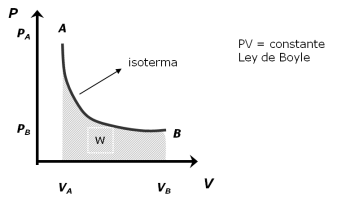
Se denomina proceso isotérmico o proceso isotermo al cambio de temperatura reversible en un sistema termodinámico, siendo dicho cambio de temperatura constante en todo el sistema.
La compresión o expansión de un gas ideal en contacto permanente con un termostato es un ejemplo de proceso isotermo, y puede llevarse a cabo colocando el gas en contacto térmico con otro sistema de capacidad calorífica muy grande y a la misma temperatura que el gas; este otro sistema se conoce como foco caliente. De esta manera, el calor se transfiere muy lentamente, permitiendo que el gas se expanda realizando trabajo. Como la energía interna de un gas ideal sólo depende de la temperatura y ésta permanece constante en la expansión isoterma, el calor tomado del foco es igual al trabajo realizado por el gas: Q = W.
Ejemplo de este tipo de proceso, son el de evaporación del agua y la fusión del hielo. Pues estos tienen un cambio de temperatura, que es constante, por lo que se le puede llamar, proceso isotérmico.
Proceso isobárico:
Un proceso isobárico es un proceso termodinámico que ocurre a presión constante. En él, el calor transferido a presión constante está relacionado con el resto de variables.
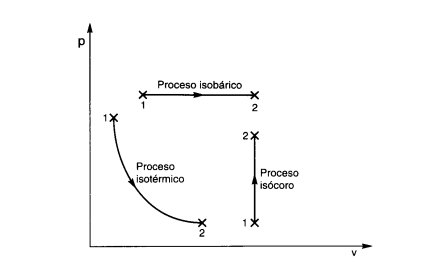
En un diagrama P – V, un proceso isobárico aparece como una línea horizontal. Si la presión no cambia durante un proceso, se dice que éste es isobárico.
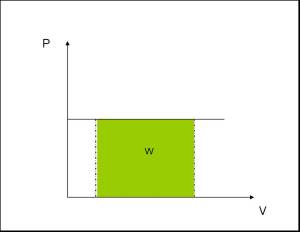
Un ejemplo de un proceso isobárico: Es la ebullición del agua en un recipiente abierto. Como el contenedor está abierto, el proceso se efectúa a presión atmosférica constante. En el punto de ebullición, la temperatura del agua no aumenta con la adición de calor, en lugar de esto, hay un cambio de fase de agua a vapor.
Proceso Isocórico:
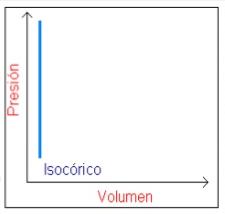
Un proceso isocórico, también llamado proceso isométrico o isovolumétrico es un proceso termodinámico en el cual el volumen permanece constante; ΔV = 0. Esto implica que el proceso no realiza trabajo presión-volumen, ya que éste se define como: Z = PΔV; donde P es la presión (el trabajo es positivo, ya que es ejercido por el sistema).
Aplicando la primera ley de la termodinámica, podemos deducir que Q, el cambio de la energía interna del sistema es: Q = ΔU, para un proceso isocórico, es decir, todo el calor que transfiramos al sistema quedará a su energía interna, U. Si la cantidad de gas permanece constante, entonces el incremento de energía será proporcional al incremento de temperatura,en un diagrama P-V, un proceso isocórico aparece como una línea vertical.
Desde el punto de vista de la termodinámica, estas transformaciones deben transcurrir desde un estado de equilibrio inicial a otro final; es decir, que las magnitudes que sufren una variación al pasar de un estado a otro deben estar perfectamente definidas en dichos estados inicial y final. De esta forma los procesos termodinámicos pueden ser interpretados como el resultado de la interacción de un sistema con otro tras ser eliminada alguna ligadura entre ellos, de forma que finalmente los sistemas se encuentren en equilibrio (mecánico, térmico y/o material) entre si. De una manera menos abstracta, un proceso termodinámico puede ser visto como los cambios de un sistema, desde unas condiciones iniciales hasta otras condiciones finales, debidos a la desestabilización del sistema.
Proceso adiabático:
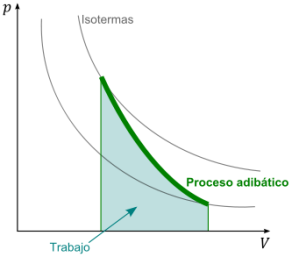
Proceso termodinámico, que se produce sin intercambio de calor con el exterior.
- No permite el intercambio de calor
- Está aislado térmicamente
- Está totalmente aislado del exterior
Las variaciones de volumen o presión de un cuerpo sin aumento o disminución de calor, es decir, no intercambia calor con su entorno. Un proceso adiabático que es además reversible se conoce como proceso isotrópico.
El calentamiento y enfriamiento adiabático son procesos que comúnmente ocurren debido al cambio en la presión de un gas. Esto puede ser cuantificado usando la ley de los gases ideales. Un gas, al dilatarse adiabáticamente, se enfría, pues la cantidad de calor que contiene se reparte en un volumen mayor; por el contrario, la compresión adiabática de dicho gas tiene por efecto un aumento de su temperatura.
En climatización los procesos de humectación (aporte de vapor de agua) son adiabáticos, puesto que no hay transferencia de calor, a pesar que se consiga variar la temperatura del aire y su humedad relativa.
Procesos termodinámicos:
Nota: Recuerda que en la parte de «Lecturas» podrás encontrar diferentes archivos formato PDF con información complementaria con respecto a los temas tratados en este blog.